如图表示了298K时氮气与氢气合成氨反应过程中的能量变化,据此请回答:(1)写出氮气与氢气合成氨的热化学反应方程式:.(2)已知在常温常压下:2CH3OH(l)+3O2(g)═2CO2(g)+4H2O
如图表示了298K时氮气与氢气合成氨反应过程中的能量变化,据此请回答:
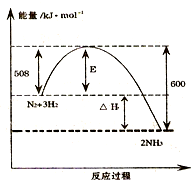
(1)写出氮气与氢气合成氨的热化学反应方程式:___.
(2)已知在常温常压下:
2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H=-a kJ•mol-1
2CO(g)+O2(g)═2CO2(g)△H=-b kJ•mol-1
H2O(g)═H2O(l)△H=-c kJ•mol-1
则,CH3OH(l)+O2(g)═CO(g)+2H2O(l)△H=___kJ•mol-1.

(1)写出氮气与氢气合成氨的热化学反应方程式:___.
(2)已知在常温常压下:
2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H=-a kJ•mol-1
2CO(g)+O2(g)═2CO2(g)△H=-b kJ•mol-1
H2O(g)═H2O(l)△H=-c kJ•mol-1
则,CH3OH(l)+O2(g)═CO(g)+2H2O(l)△H=___kJ•mol-1.
参考答案
(1)由图可知,1mol氮气与3mol氢气反应生成2mol氨气放出的热量为600kJ-508kJ=92kJ,该反应热化学方程式为:N2(g)+3H2(g)  2NH3(g)△H=-92kJ/mol,
2NH3(g)△H=-92kJ/mol,
故答案为:N2(g)+3H2(g) 2NH3(g)△H=-92kJ/mol;
2NH3(g)△H=-92kJ/mol;
(2)已知:①.2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H=-a kJ•mol-1
②.2CO(g)+O2(g)═2CO2(g)△H=-b kJ•mol-1
③.H2O(g)═H2O(l)△H=-c kJ•mol-1
根据盖斯定律,(①-②+③×4)÷2可得:CH3OH(l)+O2(g)═CO(g)+2H2O(l),则△H=
(b-a-4c) kJ/mol,
故答案为:
(b-a-4c).
 2NH3(g)△H=-92kJ/mol,
2NH3(g)△H=-92kJ/mol,故答案为:N2(g)+3H2(g)
 2NH3(g)△H=-92kJ/mol;
2NH3(g)△H=-92kJ/mol;(2)已知:①.2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H=-a kJ•mol-1
②.2CO(g)+O2(g)═2CO2(g)△H=-b kJ•mol-1
③.H2O(g)═H2O(l)△H=-c kJ•mol-1
根据盖斯定律,(①-②+③×4)÷2可得:CH3OH(l)+O2(g)═CO(g)+2H2O(l),则△H=
| 1 |
| 2 |
故答案为:
| 1 |
| 2 |
您可能感兴趣的相关题目
 看答案网
看答案网